Begge kjemiske forbindelser som kjemiske grunnstoffer består av molekyler, og disse i sin tur består av atomer. Atomer forblir forenet takket være dannelsen av den såkalte kjemiske lenker.
De kjemiske bindinger er ikke like: i utgangspunktet avhenger de av de elektroniske egenskapene til atomene som er involvert. Det er to vanligste typer lenker: ioniske bindinger og kovalente bindinger.
Vanligvis er kovalente bindinger de som hold ikke-metalliske atomer sammen. Det hender at atomene til disse elementene har mange elektroner i sitt ytterste skall og har en tendens til å beholde eller få elektroner, i stedet for å gi dem opp.
Det er grunnen til hvordan disse stoffene eller kjemiske forbindelsericos oppnå stabilitet er ved å dele et par elektroner, uikke fra hvert atom. På denne måten er det delte elektronparet felles for de to atomene og holder dem samtidig sammen. I gasser adelsmenn, for eksempel, dette skjer. Også i halogenelementer.
Når den kovalente bindingen oppstår mellom elementer med lignende elektronegativitet, som mellom hydrogen og karbon, dannes en binding apolar kovalent. Dette skjer for eksempel i hydrokarboner.
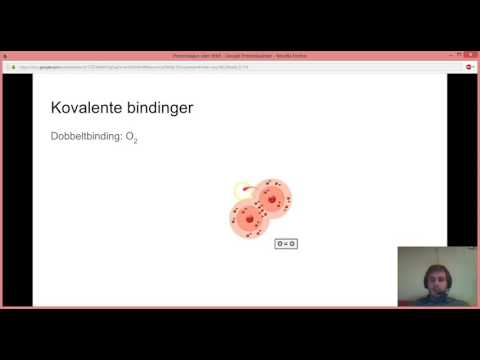
På samme måte dannes alltid homonukleære molekyler (som består av samme atom) apolare bindinger. Men hvis bindingen oppstår mellom elementer med forskjellig elektronegativitet, produseres en høyere elektrondensitet i ett atom enn i et annet, som et resultat av dette dannes en pol.
En tredje mulighet er at to atomer deler et par elektroner, men at disse delte elektronene er bidratt av bare ett atom av dem. I så fall snakker vi om dativ eller koordinere kovalent binding.
For en dativ lenke Du trenger et element med et fritt elektronpar (som nitrogen) og et annet som er elektronmangel (som hydrogen). Det er også nødvendig at den med det elektroniske paret er elektronegativ nok til ikke å miste elektronene til å dele. Denne situasjonen forekommer for eksempel i ammonium (NH4+).
De stoffer som inneholder kovalente forbindelser, kan forekomme i en hvilken som helst materie (fast, flytende eller gassformig), og generelt de er dårlige ledere av varme og strøm.
De viser ofte relativt lave smelte- og kokepunkter Y er vanligvis løselig i polare løsningsmidler, som benzen eller karbontetraklorid, men de har dårlig løselighet i vann. De er ekstremt stabile.
Tallrike eksempler på forbindelser eller stoffer som inneholder kovalente bindinger kan gis:
- Fluor
- Brom
- Jod
- Klor
- Oksygen
- Vann
- Karbondioksid
- Ammoniakk
- Metan
- Propan
- Silisiumdioksyd
- Diamant
- Grafitt
- Kvarts
- Glukose
- Paraffin
- Diesel
- Nitrogen
- Helium
- Freon


